
 272 usuarios conectados
272 usuarios conectados
/natureduca/quimica-las-moleculas-iones-y-moleculas-02

Química
LAS MOLÉCULAS
Iones y moléculas - 2ª parte
El fenómeno de la hidratación
 l carácter dipolar de la molécula de agua es el responsable de diferentes
propiedades fisicoquímicas de esta sustancia y, en particular, de su poder como
disolvente de compuestos iónicos.
l carácter dipolar de la molécula de agua es el responsable de diferentes
propiedades fisicoquímicas de esta sustancia y, en particular, de su poder como
disolvente de compuestos iónicos.
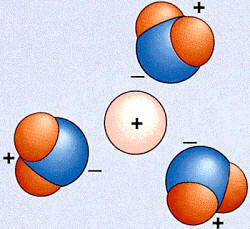
Un ion en un disolvente
polar es rodeado por los pequeños dipolos eléctricos que constituyen sus
moléculas, las cuales se orientan de modo que la carga del ion sea
envuelta por cargas de signo contrario. Si el disolvente es agua se
llama hidratación.
Cuando un cristal iónico de cloruro de sodio (NaCl) se sumerge en agua las moléculas de ésta, al ser móviles, son atraídas por los centros eléctricos fijos del cristal, orientando sus polos positivos hacia los iones negativos de la red y viceversa. Estas fuerzas atractivas ion-dipolo debilitan los enlaces entre los iones de la red cristalina, con lo que su estructura comienza a desmoronarse y al cabo de un cierto tiempo sobreviene la disolución total del cristal.
Cada ion en libertad es rodeado completamente por moléculas de agua orientadas de forma diferente según sea la polaridad de aquél. Se dice entonces que el ion está hidratado y el proceso de formación de esta capa de moléculas de agua en torno suyo se denomina hidratación.
Cuando este fenómeno implica la intervención de moléculas polares diferentes del agua recibe el nombre genérico de solvatación.
La polaridad de las moléculas y el momento dipolar
No sólo la electronegatividad desempeña un papel importante en el carácter polar o no polar de una molécula, sino también su geometría. En el caso del agua, los dos dipolos correspondientes a sus enlaces dan una suma no nula.
El efecto de la polarización de un enlace puede representarse en términos de fuerzas. Componiendo vectorialmente ambas acciones dipolares resulta un efecto conjunto no nulo responsable de los fenómenos de hidratación anteriormente descritos.
Sin embargo, es posible que una molécula posea enlaces muy polarizados, pero que en conjunto se comporte como apolar. Tal es el caso del trifluoruro de boro (BF3). Su geometría es plana, estando los átomos de flúor situados en los vértices de un triángulo equilátero y el átomo de boro en su centro geométrico.
La composición vectorial de los tres dipolos individuales da un efecto global nulo. La magnitud física que da idea de la polaridad de la molécula en su conjunto recibe el nombre de momento dipolar.

 © ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios
© ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios




