
 322 usuarios conectados
322 usuarios conectados
/natureduca/quimica-las-disoluciones-propiedades-de-las-disoluciones-02

Química
LAS DISOLUCIONES
Propiedades de las disoluciones - 2ª parte
Ósmosis y presión osmótica (continuación)
 a ósmosis se caracteriza porque el intercambio de moléculas en uno y otro
sentido no se produce a igual velocidad. Ello es debido a que el número de
moléculas de disolvente que choca con la membrana por unidad de superficie, es
mayor del lado del disolvente puro que del lado de la disolución, en donde la
presencia de moléculas de soluto entorpece el proceso.
a ósmosis se caracteriza porque el intercambio de moléculas en uno y otro
sentido no se produce a igual velocidad. Ello es debido a que el número de
moléculas de disolvente que choca con la membrana por unidad de superficie, es
mayor del lado del disolvente puro que del lado de la disolución, en donde la
presencia de moléculas de soluto entorpece el proceso.
Hay, por tanto, una presión de fluido que se ejerce del disolvente hacia la disolución y que recibe el nombre de presión osmótica. La presión osmótica, p, de una disolución depende de su concentración y se atiene a una ley semejante a la de los gases perfectos. Dicha ley fue establecida por Van't Hoff en 1897 y se expresa en la forma:
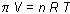
o lo que es lo mismo:
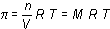
siendo M la concentración molar, R la constante de los gases y T la temperatura absoluta de la disolución.
A partir de la medida de la presión osmótica se puede determinar la masa molecular del soluto; la ley de Van't Hoff permite calcular el número de moles n, empleando como datos los resultados de las medidas de , de T y del volumen V de la disolución. La masa del soluto se determina inicialmente con la balanza, y un cálculo del tipo:
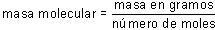
proporciona una estimación de la masa de las moléculas de soluto.
Aplicación de las leyes de Raoult
Se añade una cucharada de sal común (NaCl) a un litro de agua. Sabiendo que la masa de sal contenida en la cuchara es de 10,0 g, calcular la variación de los puntos de ebullición y congelación de la disolución. Tómese como constantes molales para el agua:
Kebullición = 0,52 Cº kg/mol Kcongelación = 1,86 Cº kg/mol
Las leyes de Raoult de variación de los puntos de ebullición y congelación pueden expresarse en la forma:
 te = Ke m
te = Ke m
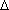 tc = Kc m
tc = Kc m
donde 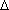 t representa la
variación del punto de transición con respecto al valor que toma para el
disolvente puro, K es la constante de proporcionalidad correspondiente, m es la molalidad y los subíndices
e y c hacen referencia a la ebullición y a la
congelación respectivamente.
t representa la
variación del punto de transición con respecto al valor que toma para el
disolvente puro, K es la constante de proporcionalidad correspondiente, m es la molalidad y los subíndices
e y c hacen referencia a la ebullición y a la
congelación respectivamente.
Se trata entonces de calcular, como paso previo, la concentración molal de la disolución:
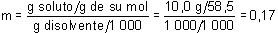
ya que la masa molecular del NaCl es:
M(NaCl) = 23,0 + 35,5 = 58,5
y la densidad del agua es 1 g/cm3.
Por tanto:
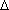 te = 0,52 · 0,17
= 0,09 Cº
te = 0,52 · 0,17
= 0,09 Cº
 tc = 1,86 · 0,17
= 0,32 Cº
tc = 1,86 · 0,17
= 0,32 Cº
La baja concentración molal resultante da lugar a pequeñas variaciones de los puntos de transición.

 © ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios
© ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios




