
 69 usuarios conectados
69 usuarios conectados
/natureduca/quimica-el-lenguaje-quimico-compuestos-binarios-y-seudobinarios-02

Química
EL LENGUAJE QUÍMICO
Compuestos binarios y seudobinarios - 2ª parte
Compuestos binarios del oxígeno (continuación)
Ejemplos de nomenclatura
 n general, el proceso será inverso al de formulación. Si se tratase de
nombrar el Cl2O, por los símbolos se reconocería que es un óxido de cloro; pero
dado que el cloro actúa con diferentes índices de oxidación, al observar la
ausencia de subíndice en el oxígeno concluimos que se trata, en este caso, del
cloro (I), por lo que el nombre correcto será óxido de cloro (I). Asimismo
podría haberse nombrado eligiendo la segunda forma de nomenclatura como el
monóxido de dicloro.
n general, el proceso será inverso al de formulación. Si se tratase de
nombrar el Cl2O, por los símbolos se reconocería que es un óxido de cloro; pero
dado que el cloro actúa con diferentes índices de oxidación, al observar la
ausencia de subíndice en el oxígeno concluimos que se trata, en este caso, del
cloro (I), por lo que el nombre correcto será óxido de cloro (I). Asimismo
podría haberse nombrado eligiendo la segunda forma de nomenclatura como el
monóxido de dicloro.
Para los demás casos se procederá análogamente:

A propósito de los óxidos cabe señalar una cuestión que es de aplicación general para todo tipo de compuesto químico. Al igual que sucede con los átomos, la condición de molécula o de agrupación iónica equivalente lleva aparejada la neutralidad eléctrica.
Por esta razón el número que resulta de la suma algebraica de los índices de oxidación de cada uno de los átomos que intervienen en la fórmula ha de ser igual a cero. Para conseguirlo los átomos de cada elemento han de intervenir en número suficiente como para que se compensen mutuamente los índices de oxidación.
Tomando por ejemplo los casos anteriores se tiene:
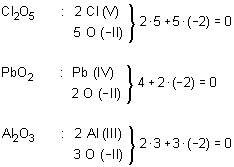
De acuerdo con esto y recordando que cada símbolo representa un átomo del correspondiente elemento, resulta fácil comprender el porqué de los subíndices, así como la razón del intercambio de los números de oxidación.
Compuestos binarios del hidrógeno
Tanto la nomenclatura como la formulación de tales compuestos se rige por las normas generales; sin embargo, es preciso hacer constar que las combinaciones binarias del hidrógeno con los elementos F, Cl, Br, I, S, Se, Te, que le siguen en la ordenación de la I.U.P.A.C., reciben el nombre especial de hidrácidos, pues tales compuestos, en solución acuosa, se comportan como ácidos.
Por esta razón, cuando se hallan disueltos en agua se nombran anteponiendo la palabra ácido al nombre abreviado del elemento (que junto con el hidrógeno forma la combinación), al que se le añade la terminación hídrico. Los referidos elementos actúan en tal caso con su número de oxidación más bajo: -I para los cuatro primeros y -II para los tres últimos.

 © ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios
© ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios




