
 160 usuarios conectados
160 usuarios conectados
/natureduca/quimica-elementos-quimicos-y-sistema-periodico-la-explicacion-del-sistema-04

Química
ELEMENTOS QUÍMICOS Y SISTEMA PERIÓDICO
La explicación del sistema periódico - 4ª parte
Algunas propiedades periódicas
Volumen atómico
 l primero en investigar de una forma sistemática la
periodicidad de las propiedades presente en la clasificación de los elementos
fue el químico alemán Julius Lothar Meyer (1830-1895). Con el propósito de poner
claramente de manifiesto tal periodicidad, Meyer tuvo la brillante idea de
representar diferentes propiedades físicas de los elementos conocidos en función
de su masa atómica.
l primero en investigar de una forma sistemática la
periodicidad de las propiedades presente en la clasificación de los elementos
fue el químico alemán Julius Lothar Meyer (1830-1895). Con el propósito de poner
claramente de manifiesto tal periodicidad, Meyer tuvo la brillante idea de
representar diferentes propiedades físicas de los elementos conocidos en función
de su masa atómica.
Así, a partir de las masas atómicas y de las densidades correspondientes en estado sólido o líquido, calculó los volúmenes atómicos como cociente de ambas. La representación gráfica del volumen atómico en función de la masa atómica dio lugar a una gráfica en la que se apreciaba una serie de ondas que mostraba una cierta repetición o periodicidad.
En esta gráfica se observa
la periodicidad en la variación de las propiedades con el número
atómico. Los máximos y mínimos coinciden con elementos de una misma
familia del sistema periódico.
La representación actualizada de la gráfica de Meyer se efectúa en función del número atómico y no de la masa atómica. Cada descenso y ascenso por la gráfica resultante corresponde a un periodo. La distancia entre los picos no es la misma, lo que refleja que la longitud de los periodos de la tabla tampoco debe serlo.
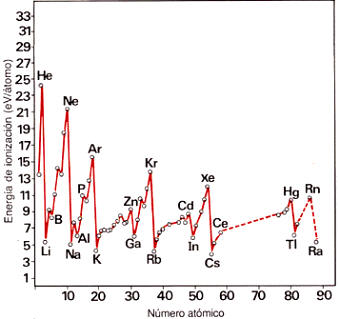
Energía de ionización
La energía de ionización de un átomo es la energía mínima que se le debe comunicar en el estado gaseoso para arrancarle un electrón. Dado que, salvo para el átomo de hidrógeno, el proceso puede repetirse varias veces, se distingue entre la primera energía de ionización, la segunda, etc. Debido a la importancia que tiene la pérdida de electrones por los átomos en los procesos químicos, la energía de ionización proporciona una valiosa información sobre el comportamiento químico de un elemento.
La representación gráfica de la variación de la primera energía de ionización con el número atómico da lugar a una línea quebrada repetitiva que refleja una cierta periodicidad. En ella los puntos de máxima energía de ionización corresponden a los gases nobles, lo que indica configuraciones electrónicas muy estables y explica su escasa reactividad química.
Por el contrario, los metales alcalinos ocupan los puntos de mínimo; su único electrón externo puede ser arrancado con relativa facilidad. Ello es debido a que además de ser dentro de cada periodo, los de menor carga nuclear son los de mayor volumen atómico; ambas circunstancias favorecen el que la atracción que ejerce el núcleo sobre el electrón externo sea menor, lo cual se traduce en una menor energía de ionización.

 © ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios
© ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios




