
 239 usuarios conectados
239 usuarios conectados
/natureduca/quimica-elementos-quimicos-y-sistema-periodico-la-explicacion-del-sistema-01

Química
ELEMENTOS QUÍMICOS Y SISTEMA PERIÓDICO
La explicación del sistema periódico - 1ª parte
Introducción
 a elaboración de la tabla de Mendeleiev fue efectuada
tomando como principio de construcción la idea de periodicidad de las
propiedades, sin embargo, quedaba por encontrar una explicación más profunda a
esa regularidad observada. La ordenación de los elementos según el número
atómico supone una primera aproximación hacia la explicación de la tabla que
está relacionada con el moderno concepto de elemento químico.
a elaboración de la tabla de Mendeleiev fue efectuada
tomando como principio de construcción la idea de periodicidad de las
propiedades, sin embargo, quedaba por encontrar una explicación más profunda a
esa regularidad observada. La ordenación de los elementos según el número
atómico supone una primera aproximación hacia la explicación de la tabla que
está relacionada con el moderno concepto de elemento químico.
Así el número atómico es el número de orden del sistema periódico, pero también representa el número de protones presentes en el núcleo del átomo correspondiente. Dado que el átomo es eléctricamente neutro, el número atómico coincide también con el número de electrones de la corteza. La estructura interna del átomo parece entonces contener la clave de la explicación de la clasificación periódica de los elementos.
Cada una de las casillas del sistema periódico define un elemento químico y sólo uno. Átomos que, teniendo el mismo número atómico difieran en su número másico porque posean núcleos con un número de neutrones diferente, ocuparán la misma casilla y corresponderán, por tanto, al mismo elemento. Éste es el origen del término, isótopo -en griego significa igual lugar- que describe esta situación. En la naturaleza cada sustancia simple o elemento químico es de hecho una mezcla de isótopos (átomos con igual número atómico y diferente número másico) y no un conjunto de átomos exactamente iguales como supuso Dalton.
La arquitectura electrónica
El átomo completo de un elemento dado puede compararse con un edificio. Los sótanos estarían representados, en este símil, por el núcleo y el resto del edificio por la corteza, siendo los electrones sus ladrillos. La forma en que los electrones se distribuyen en el átomo determina la arquitectura del edificio, y los orbitales, o lo que es lo mismo, sus niveles energéticos, constituyen las plantas y entresuelos de esta construcción atómica.
El método de construcción de la estructura o configuración electrónica de un átomo cualquiera se basa en tres reglas fundamentales sancionadas por la mecánica cuántica:
a) La regla n + l. En ausencia de un campo magnético la energía de un orbital viene determinada únicamente por los números cuánticos n y l, siendo de más baja energía el orbital cuya suma n + l sea menor. Cuando dos orbitales tienen el mismo valor de n + l, el de menor energía es aquel que tiene menor número cuántico n. Dado que los electrones en el átomo tienden a adoptar las configuraciones más estables o de menor energía, la regla n + l determina, en una primera aproximación, el orden de llenado de los orbitales que resulta ser el siguiente: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p, 8s ...

El esquema representa
gráficamente el orden de llenado de los orbitales de acuerdo con la regla
n+1. El color de las flechas sirve para distinguir un periodo de otro.
b) Principio de exclusión de Pauli. En un átomo no es posible encontrar dos
electrones con los cuatro números cuánticos, n, l, ml y ms iguales. Dado que un
orbital está definido por los tres primeros números cuánticos, el número máximo
de electrones permitidos por orbital será dos. En tal caso, y para diferir al
menos en ms, ambos deberán estar apareados, es decir, con número cuántico de
espin opuesto, lo cual se representa en la forma
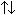 . El principio de exclusión,
junto con las relaciones existentes entre los números cuánticos n, l y ml
determina el número máximo de electrones que pueden existir para cada valor del
número cuántico principal n y del número cuántico secundario l. Para cada
n el
número máximo de electrones es 2n2.
. El principio de exclusión,
junto con las relaciones existentes entre los números cuánticos n, l y ml
determina el número máximo de electrones que pueden existir para cada valor del
número cuántico principal n y del número cuántico secundario l. Para cada
n el
número máximo de electrones es 2n2.
Análogamente en un nivel s podrán alojarse, como máximo, 2 electrones; en un nivel p, 6; en uno d, 10 y en uno f, 14, lo cual se suele expresar en la forma ns2, np6, nd10, nf14... donde los exponentes representan índices máximos de ocupación.
c) La regla de Hund o de la máxima multiplicidad. La configuración electrónica más estable es aquella que permite el mayor número de electrones despareados. Por tanto, un segundo electrón no ocupará un mismo orbital correspondiente a un nivel energético dado, en tanto todos los orbitales de ese mismo nivel no estén semiocupados. Esta regla precisa más aún el orden de llenado establecido por la regla n + l.

 © ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios
© ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios




