
 136 usuarios conectados
136 usuarios conectados
/natureduca/quimica-elementos-quimicos-y-sistema-periodico-la-masa-de-los-atomos-y-de-los-elementos-01

Química
ELEMENTOS QUÍMICOS Y SISTEMA PERIÓDICO
La masa de los átomos y de los elementos - 1ª parte
La primera tabla de masas atómicas
 oco después de formular su hipótesis atómica sobre la
constitución de la materia, Dalton emprendió la tarea de calcular las masas de
los átomos de los elementos entonces conocidos.
oco después de formular su hipótesis atómica sobre la
constitución de la materia, Dalton emprendió la tarea de calcular las masas de
los átomos de los elementos entonces conocidos.
Por su tamaño los átomos de Dalton no podían verse ni mucho menos pesarse directamente, lo cual no fue un obstáculo insalvable para este químico inglés. En sus estudios sobre las reacciones químicas Dalton había llegado a la conclusión de que cuando dos elementos se combinan para dar un compuesto lo hacen en proporciones sencillas y constantes (ley de proporciones definidas).
Por lo tanto, sería posible, tomando como elemento de referencia el hidrógeno, determinar la proporción en la que los otros elementos se combinan con él. Teniendo en cuenta las nociones de elemento y de compuesto de Dalton, tal proporción constituía, en efecto, una medida relativa de la masa del átomo del elemento en cuestión respecto a la del hidrógeno.
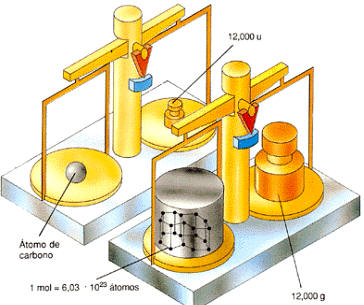
La unidad de masa atómica
(u) se define como 1/12,000 veces la masa del átomo del isótopo más
abundante de carbono, es decir la del carbono-12.
A partir de estas ideas, Dalton llegó a establecer una tabla de masas atómicas que incluía la mayor parte de los elementos entonces conocidos. En ella la masa atómica del hidrógeno se consideraba 1, la del nitrógeno 5, la del carbono 5, la del fósforo 9, la del azufre 13, etc.
El error fundamental de Dalton en tales determinaciones consistió en suponer, en más casos de los debidos, que los átomos se combinaban en la proporción 1 a 1. Así en su fórmula para el agua la representa como formada por la unión de un átomo de hidrógeno y otro de oxígeno, y dado que las masas de oxígeno e hidrógeno necesarias para formar agua estaban en la proporción 7 a 1 concluyó que la masa del átomo de oxígeno era siete veces mayor que la del hidrógeno.
Sin embargo, la molécula del agua estaba formada por dos átomos de hidrógeno y uno de oxígeno, por lo que, de haberlo tenido en cuenta, hubiera propuesto una masa atómica doble. Cuando se efectúan mediciones más precisas se advierte que la proporción es de 8 a 1 y que, por tanto, la masa atómica del oxígeno relativa al hidrógeno debe ser 16.
Ilustración MS Encarta
A pesar de sus errores la tabla de Dalton abrió el camino hacia la determinación de masas atómicas por procedimientos indirectos, y un conocimiento más exacto de las fórmulas químicas permitió perfeccionar este tipo de datos.

 © ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios
© ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios




