
 141 usuarios conectados
141 usuarios conectados
/natureduca/quimica-acidez-y-basicidad-conceptos-actuales-de-acido-y-base-04

Química
ACIDEZ Y BASICIDAD
Conceptos actuales de ácido y base - 4ª parte
Valoraciones de ácido-base
 na disolución ácida puede neutralizarse con otra básica (y
viceversa) parcial o totalmente. La neutralización total, que lleva consigo la
pérdida de propiedades de ácido o de base por la disolución, se consigue cuando
se igualan sus concentraciones de iones H3O+ y OH-.
na disolución ácida puede neutralizarse con otra básica (y
viceversa) parcial o totalmente. La neutralización total, que lleva consigo la
pérdida de propiedades de ácido o de base por la disolución, se consigue cuando
se igualan sus concentraciones de iones H3O+ y OH-.
La utilización de un pH-metro o de un indicador adecuado señalará el momento o punto final de la reacción, que se alcanza cuando el pH de la disolución toma un valor igual a siete. El proceso correspondiente recibe el nombre de análisis volumétrico o valoración ácido-base y es una técnica frecuente en los laboratorios químicos.
Los cálculos químicos para esta reacción de neutralización se efectúan con la ayuda de la ecuación:Vácido Mácido nácido = Vbase Mbase nbase
donde V representa el volumen, M la concentración molar y n el número de protones cedidos (nácido) o aceptados (nbase) por cada molécula de ácido o de base respectivamente. Dicha ecuación traduce el hecho de que, para alcanzar el punto final de la reacción, el número total de protones cedidos por el ácido ha de ser igual al número total de protones aceptados por la base.El producto V · M representa, de acuerdo con la definición de molaridad, el número de motes, el cual es proporcional al número de moléculas (1 mol = NA moléculas, siendo NA el número de Avogadro). Luego el producto V · M · n es proporcional en ambos casos al número de protones cedidos por el ácido o aceptados por la base, según la correspondiente ecuación química, siendo la constante de proporcionalidad la misma para ambos e igual a
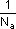
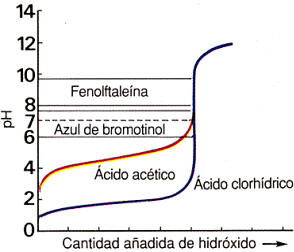
La curva de valoración en
una gráfica en la que se representa la variación de pH con la cantidad
de disolución patrón añadida a la disolución problema.
El punto de corte de la gráfica con la línea horizontal de pH = 7 define el punto final de la valoración. En la figura se advierte cómo en el entorno de ese punto la pendiente de la gráfica se hace muy elevada, lo que significa que pequeñas cantidades de disolución producen cambios importantes en el pH. En tal circunstancia la adición de disolución patrón ha de efectuarse gota a gota para no sobrepasar el valor neutro del pH.

 © ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios
© ASOCAE ONGD, Asociación Española para la Cultura, el Arte y la Educación -
www.asocae.org - RNA 592727 - CIF.: G70195805 ¦
Quiénes somos ¦
Contacto ¦
Bibliografía ¦
Política de privacidad ¦
Esta web NO utiliza cookies, ni guarda datos personales de los usuarios




